Все металлы в твердом состоянии имеют кристаллическое строение. Атомы в твердом металле расположены упорядочение и образуют кристаллические решетки (рис. 1).
Рис. 1. Схемы кристаллических решеток: а – объемно-центрированная кубическая; б –гранецентрированная; в – гексагональная плотноупакованная
Кристаллическая решетка представляет собой наименьший объем кристалла, дающий полное представление об атомной структуре металла, и носит название элементарной ячейки.
Для металлов характерны кристаллические решетки трех видов: кубическая объемно-центрированная (ОЦК), в которой атомы расположены по вершинам элементарной ячейки и один в ее центре; кубическая гранецентрированная (ГЦК), в которой атомы расположены по вершинам элементарной ячейки и в центрах ее граней; гексагональная плотноупакованная (ГПУ), представляющая собой шестигранную призму, в которой атомы расположены в три слоя.
Свойства материала зависят от вида кристаллическ4ой решетки и параметров, ее характеризующих:
1) межатомное расстояние , измеряется в ангстремах 1А°=10 -8 см
2) плотность упаковки (базис решетки – число частиц, приходящихся на одну элементарную ячейку). Кубическая простая – Б1, ОЦК – Б2, ГЦК – Б4, ГПУ – Б6.
3) координационное число (КЧ) – максимальное количество атомов равноудаленных и находящихся на ближайшем расстоянии от атома, взятоого за точку отсчета. Кубическая простая – КЧ=6, ОЦК – КЧ=8, ГЦК – КЧ=12, ГПУ – КЧ=12.

Свойства материала, определенные в направлении передней плоскости и диагональной плоскости, отличаются – это явление называется анизотропия , т. е. неравномерность свойств в различных направлениях. Этим свойством обладают все металлические материалы. Аморфные тела обладают свойством изотропии , т.е. имеют одинаковые свойства во всех направлениях.
Кристаллические решетки могут иметь различные структурные несовершенства, существенно изменяющие свойства материала. Реальный единичный кристалл всегда имеет свободную (наружную) поверхность, на которой уже вследствие поверхностного натяжения решетка искажена.
Дефекты внутреннего строения подразделяют на точечные, линейные и плоскостные.
К точечным дефектам относятся вакансии (когда отдельные узлы кристаллической решетки не заняты атомами); дислоцированные атомы (если отдельные атомы оказываются в междоузлиях) или примесные атомы, количество которых даже в чистых металлах весьма велико. Около таких дефектов решетка будет упруго искаженной на расстоянии одного-двух периодов (рис. 2, а).

Рис. 2. Дефекты кристаллической решетки : а - точечные; б - линейные; в - плоскостные
Линейные дефекты малы в двух измерениях и достаточно велики в третьем. К таким дефектам относятся смещение атомных плоскостей или дислокации и цепочки вакансий (рис. 2,б). Важнейшим свойством таких дефектов являются их подвижность внутри кристалла и активное взаимодействие между собой и с другими дефектами.
Изменение кристаллической решетки материала возможно под воздействием внешних факторов, а именно температуры и давления. Некоторые металлы в твердом состоянии в различных температурных интервалах приобретают разные кристаллические решетки, что всегда приводит к изменению их физико-химических свойств.
Существование одного и того же металла в нескольких кристаллических формах носит название полиморфизма . Температура, при которой происходит изменение кристаллической решетки – называется температурой полиморфного превращения. На этом явлении основаны все процессы термической обработки. Полиморфные модификации обозначают греческими буквами (a, b, g и другими, которые в виде индекса добавляют к символу элемента).

Плотность упаковки – это доля объема кристаллической решетки, занятая атомами.
Кратчайшее расстояние между центрами двух шаров в элементарной ячейке равно двум радиусам шара – 2r. Объем шара V = 4/3r 3 , объем шаров, входящих в элементарную ячейку, V n = 4/3nr 3 , где n – кратность элементарной ячейки. Если объем элементарной ячейки V 0 , то плотность упаковки равна Р = (V n /V 0)·100 %.
Если период решетки равен а, то V 0 = а 3 , решение задачи сводится к выражению атомного радиуса через период решетки, для конкретной структуры следует определить кратчайшее межатомное расстояние, например, в алмазе 2r = a /4 (кратчайшее расстояние, равное двум атомным радиусам, составляет четверть пространственной диагонали куба).
В табл. 2.3 приведены результаты расчета плотности упаковки для различных структур.
Таблица 2.3
Плотность упаковки для различных структур
|
Тип решетки |
К. ч. |
Атомный радиус r |
Кратность ячейки n | |
|
Кубическая примитивная | ||||
С повышением координационного числа плотность упаковки растет.
Заполнение междоузлий в ГЦК решетке, что соответствует повышению кратности элементарной ячейки, приводит к менее плотным упаковкам.
2.8. Связь между типом структуры, координационным числом и электрофизическими свойствами
Плотнейшие и плотные упаковки (Р = 68 – 74 %) с к.ч. 8/8 и 12/12 типичны для металлов (структуры ОЦК, ГЦК, ГПУ) .
Наименее плотные упаковки (Р = 34 % и подобными) с к.ч. 4/4 (структуры алмаза, сфалерита, вюрцита), 4/2 (куприт), 2/2 (селен) типичны для полупроводников.
Структуры с промежуточными значениями к.ч. 6/6 и плотности Р 67 %, например, типаNaCl, могут иметь и проводниковые свойства (TiO, TiN, VN, TiC и др.), и полупроводниковые свойства (PbS, PbSe, PbTe), и диэлектрические (NaCl, MgO, CaO, BaO).
Металлические вещества могут кристаллизоваться и в структуры с низкими к.ч., например, в графите к.ч. равно 4, как и в алмазе.
Важнейшие полупроводники образуют следующие структуры:
алмаза: Si,Ge, α-Sn;
сфалерита: ZnS, HgS, CdTe, AlP, AlAs, AlSb, GaP, GaAs, GaSb, InP, InAs, InSb, SiC, ZnSe, HgSe, ZnTe, HgTe;
куприта: Cu 2 O, Ag 2 O;
флюорита: Mg 2 Si, Mg 2 Ge;
вюрцита: ZnS, ZnO, CdS, CdSe;
хлорида натрия: PbS, PbSe, PbTe;
арсенида никеля: VS, VSe, FeS, FeSe.
2.9. Островные, цепные и слоистые структуры
Кроме координационных структур, в которых межатомные расстояния между всеми структурными единицами одинаковы (один тип связи), в островных, цепных и слоистых структурах (рис.2.15) могут быть выделены группы атомов, которые образуют «острова» (молекулы), непрерывно простирающиеся в одном направлении (цепи), или бесконечные в двух (слои) или трех (каркасы) измерениях. Такие структуры являются молекулярными.
На рис. 2.15 а изображены островные структуры: 1 - линейные, 2 – двумерные (квадрат), 3 – трехмерные (тетраэдр). На рис. 2.15 b показаны цепные структуры: 4 – линейная, 5 – цигзагообразная, 6 и 7 – звенья из октаэдров и тетраэдров.

Рис.2.15. Островные и цепные структуры
Контрольные вопросы
Какая решетка называется простой, сложной?
Чем поликристалл отличается от монокристалла?
Что обозначает запись: (hkl), {hkl}, < hkl>, ?
Какие значения могут принимать индексы Миллера?
Запишите индексы Миллера плоскостей, перпендикулярных ребрам куба.
Запишите индексы Миллера плоскостей, перпендикулярных диагоналям граней куба.
Запишите индексы Миллера плоскостей, параллельным граням куба.
Запишите индексы Миллера направлений, перпендикулярных граням куба.
В чем отличие (110), {110 }, < 110>, ?
Какое явление называется полиморфизмом?
Что такое изоморфизм?
Чем отличается строение стекол от строения кристаллов?
Каковы особенности строения аморфных тел?
Какие структуры относятся к плотным упаковкам? Как расположены в них атомы?
В чем отличие ГПУ от ГЦК?
Чему равны координационные числа в плотных упаковках?
Где расположены тетраэдрические междоузлия в ГЦК решетке?
Где расположены октаэдрические междоузлия в ГЦК решетке?
Что называется политипизмом?
Что называется кратностью элементарной ячейки?
Чем отличаются различные типы кубических структур?
Изобразите элементарные ячейки меди, кремния, NaCl, CsCl, сфалерита.
Поясните расположение атомов в решетке вюрцита.
На основе какой плотной упаковки строится решетка вюрцита?
На основе какой плотной упаковки строится решетка сфалерита?
Сколько атомов приходится на элементарную ячейку вюрцита?
Как рассчитывается плотность упаковки кристаллических структур?
Какие кристаллические решетки имеют максимальную плотность упаковки?
Какие кристаллические решетки имеют минимальную плотность упаковки?
Как связана плотность упаковки с координационным числом?
Можно ли отнести цепные структуры к координационным? Почему?
В чем разница между дальним и ближним порядком в твердых телах?
Молекулярные кристаллы. В узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаимным смещением электронов в электронных оболочках атомов. Эти силы называются ван-дер-ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Молекулярными кристаллами являются, например, большинство органических соединений (парафин, спирт, резина и т. д.), инертные газы (Ne, Ar, Кг, Хе) и газы СО 2 , О 2 , N2 в твердом состоянии, лед, а также кристаллы брома Вг 2 , иода 1 2 . Ван-дер-ваальсовы силы довольно слабые, поэтому молекулярные кристаллы легко деформируются.
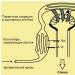
В некоторых твердых телах одновременно может осуществляться несколько видов связи. Примером может служить графит (гексагональная решетка). Решетка графита (рис. 105) состоит из ряда параллельных плоскостей, в которых атомы углерода расположены в вершинах правильных шестиугольников. Расстояние между плоскостями более чем в два раза превышает расстояние между атомами шестиугольника. Плоские слои связаны друг с другом ван-дер-ваальсовыми силами. В пределах слоя три валентных электрона каждого атома углерода образуют ковалентную связь с соседними атомами углерода, а четвертый электрон, оставаясь «свободным», коллективизируется, но не во всей решетке, как в случае металлов, а в пределах одного слоя. Таким образом, в данном случае осуществляются три вида связи: гомеополярная и металлическая - в пределах одного слоя; ван-дер-ваальсова - между слоями. Этим объясняется мягкость графита, так как его слон могут скользить друг относительно друга.
Различие в строении кристаллических решеток двух разновидностей углерода - графита и алмаза - объясняет различие в их физических свойствах: мягкость графита и твердость алмаза; графит - проводник электричества, алмаз - диэлектрик (нет свободных электронов) и т. д.
Расположение атомов в кристаллах характеризуется также координационным числом - числом ближайших однотипных с данным атомом соседних атомов в кристаллической решетке или молекул в молекулярных кристаллах. Для модельного изображе-
ния кристаллических структур из атомов и ионов пользуются системой плотной упаковки шаров. Рассматривая простейший случай плотной упаковки шаров одинакового радиуса на плоскости, приходим к двум способам их расположения (рис. 106, а, б). Правая упаковка является более плотной, так как при равном числе шаров площадь ромба со стороной, равной стороне квадрата, меньше площади квадрата. Как видно из рисунка, различие в упаковках сводится к различию координационных чисел: в левой упаковке координационное число равно 4, в правой - б, т. с. чем плотнее упаковка, тем больше координационное число.
Рассмотрим, при каких условиях плотная упаковка шаров в пространстве может соответствовать той или иной кристаллической структуре, приводимой ранее. Начнем строить решетку со слоя шаров, представленных на рис. 106, 6. Для упрощения дальнейших рассуждений спроецируем центры шаров на плоскость, на которой они лежат, обозначив их белыми кружками (рис. 107). На эту же плоскость спроецируем центры просветов между шарами, которые обозначены на рис. 107 соответственно черными кружками и крестиками. Любой плотноупакованный слой будем называть слоем А, если центры его шаров расположены над серыми кружками, слоем В - если над красными кружками, слоем С - если над крестиками. Над слоем А уложим второй плотноупакованный слой так, чтобы каждый шар этого слоя лежал на трех шарах первого слоя. Это можно сделать двояко: взять в качестве второго слоя либо В, либо С. Третий слой "можно опять уложить двояко и т. д. Итак, плотную упаковку можно описать как последовательность АВСВАС..., в которой не могут стоять рядом слои, обозначенные одинаковыми буквами.
Из множества возможных комбинаций в кристаллографии реальное значение имеют два типа упаковки: 1) двухслойная упаковка АВАВАВ... - гексагональная плотно-упакованная структура (рис. 108); 2) трехслойная упаковка АВСАВС... - кубическая гранецентрированная структура (рис. 109). В обеих решетках координационное число равно 12 и плотность упаковки одинакова - атомы занимают 74% общего объема кристалла. Координационное число, соответствующее кубической объемно центрированной решетке, равно 8, решетке алмаза (см. рис. 104) равно 4.
Кроме двух- и трехслойных упаковок можно построить многослойные с большим периодом повторяемости одинаковых слоев, например АВСВАСАВСВАС... - шести-слойная упаковка. Существует модификация карбида SiC с периодом повторяемости 6, 15 и 243 слоя.
Если кристалл построен из атомов различных элементов, то его можно представить в виде плотной упаковки шаров разных размеров. На рис. 110 приведено модельное изображение кристалла поваренной соли. Крупные ионы хлора (г = 181 пм) образуют плотную трехслойную упаковку, у которой большие пустоты заполнены меньшими по
размеру ионами натрия (г=98 пм). Каждый ион Na окружен шестью ионами О и, наоборот, каждый ион С1 - шестью ионами Na.
Дефекты в кристаллах
Рассмотренные в § 71 идеальные кристаллические структуры существуют лишь в очень малых объемах реальных кристаллов, в которых всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки, называемые д е ф е кт а ми кристаллической решетка. Дефекты делятся на макроскошпические, возникающие в процессе образования и роста кристаллов (например, трещины, поры, инородные макроскопические включения), и макроскопические, обусловленные микроскопическими отклонениями от периодичности.
Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трех типов: 1) вакансия - отсутствие атома в узле кристаллической решетки (рис. 111, а); 2) междоуэельный атом - атом; внедрившийся в междоузельное пространство (рис. 111, 6); 3) примесный атом - атом примеси, либо замещающий атом основного вещества в кристаллической решетке (примесь замещения, рис. 111, в), либо внедрившийся в междоузельное пространство (примесь введения, рис. 111, б; только в междоузлии вместо атома основного вещества располагается атом примеси). Точечные дефекты нарушают лишь ближний порядок в кристаллах, не затрагивая дальнего порядка, - в этом состоит их характерная особенность.
Линейные дефекты нарушают дальний порядок. Как следует из опытов, механические свойства кристаллов в значительной степени определяются дефектами особого вида - дислокациями. Дислокации - линейные дефекты, нарушающие правильное чередование атомных плоскостей.
Дислокации бывают краевые и винтовые. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию (рис. 112, а). В случае винтовой дислокации (рис. 112, б) ни одна из атомных плоскостей внутри кристалла не обрывается, а сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности.
Плотность дислокаций (число дислокаций, приходящихся на единицу площади поверхности кристалла) для совершенных монокристаллов составляет 10 2 -10 3 см -2 , для деформированных кристаллов- 10 10 -10 12 см -2 . Дислокации никогда не обрываются, они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций. Дислокации и их движение можно наблюдать с помощью электронного микроскопа, а также методом избирательного травления - в местах выхода дислокации на поверхность возникают ямки травления (интенсивное разрушение кристалла под действием реагента), «проявляющие» дислокации.
Кристалл с определенной химической формулой имеет присущую ему кристаллическую структуру.
Кристаллические структуры - это структуры, представляющие периодическую решетку, в узлах которой расположены атомы. Трехмерная кристаллическая структура представляет решетку, построенную на трех координатных осях x, y, z, расположенных в общем случае под углами a, b, g . Периоды трансляции атомов по осям (параметры решетки) равны, соответственно, a, b, c. Элементарная ячейка кристалла - это параллелепипед, построенный на векторах трансляции a, b, c. Такая ячейка называется примитивной.
В результате трансляции элементарной ячейки в пространстве получается пространственная простая решетка - так называемая решетка Браве. Существует четырнадцать типов решеток Браве. Эти решетки отличаются друг от друга видом элементарных ячеек.
Решетки Браве подразделяются на семь систем, называемых кристаллографическими сингониями, в соответствии с семью различными типами элементарных ячеек: триклинной, моноклинной, ромбической, тетрагональной, тригональной, кубической и гексагональной. Эти элементарные ячейки могут быть как примитивными, так и сложными.
На рисунке изображены сложные элементарные ячейки.
а)объемноцентрированная б)гранецентрированная
в) базоцентрированная г) гексагональная
Объемноцентрированная
(ОЦ) ячейка (рис. а) - содержит дополнительно один атом на пересечении пространственных диагоналей куба (или, в общем случае, параллелепипеда). В ОЦ кубической структуре (ОЦК) кристаллизуются такие металлы, как 23 V, 24 Cr, 26 Fe, 41 Nb, 73 Ta, 74 W (индекс слева внизу обозначает номер элемента в периодической системе элементов Д. И. Менделеева
).
Гранецентрированная
(ГЦ) ячейка (рис. б) - содержит дополнительно по одному атому в плоскости каждой грани. В ГЦ кубической структуре (ГЦК) кристаллизуются металлы 13 Al, 28 Ni, 29 Cu, 47 Ag, 78 Pt, 79 Au и др.
Базоцентрированная
(БЦ) ячейка (рис. в) - содержит дополнительно по одному атому в центрах противоположных граней.
Гексагональная ячейка
(рис. г) состоит из трех примитивных ячеек, и, как и БЦ ячейка, содержит по одному атому в центре противоположных граней. В гексагональной структуре кристаллизуются многие металлы - 22 Ti, 27 Co, 30 Zn, 39 Y, 40 Zr, 64 Gd, 71 Lu.
Различные кристаллографические систем отличаются друг от друга формой элементарной ячейки: соотношениями между длинами ребер a, b и c и углами α, β и γ между гранями.
В триклинной
системе (где нет осей и плоскостей симметрии) такая ячейка представляет собой параллелепипед, все ребра и углы которого не равны между собой. В моноклинной
- это наклонный параллелепипед; в ромбической
(или орторомбической) - прямоугольный параллелепипед с неравными ребрами, в тетрагональной
- прямоугольный параллелепипед, в основании которого лежит квадрат; в тригональной
(ромбоэдрической) - прямоугольный ромбоэдр, стороны которого равны, а углы одинаковы, но отличны от 90 о и меньше, чем 120 о; в гексагональной
- прямую призму, основанием которой является ромб с углами 120 о и 60 о, а три ячейки составляют шестигранную призму; в кубической системе элементарная ячейка представляет собой куб.
В настоящее время выделено уже более тысячи структурных типов, однако они охватывают лишь несколько процентов известных кристаллических структур.
В международной классификации по группам структур принята следующая классификация:
А
- элементы;
В
- соединения типа АВ (например, NaCl, CsI);
С
- соединения типа AB 2 (CaF 2 , TiO 2);
D
- соединения типа A n B m (Al 2 O 3);
E
- соединения, образованные больше, чем двумя сортами атомов без радикалов или комплексных ионов (например, CuFeS);
F
-структуры соединений с двух- или трехатомными ионами (KCNS, NaHF 2);
G
- соединения с четырехатомными ионами (CaCO 3 , NaClO 3);
H
- соединения с пятиатомными ионами (CaSО 4 .2H 2 O, CaWO 4);
L
- сплавы;
S
-силикаты.
Разновидности типов внутри группы различаются номерами.
Понятие структурный тип
- один из критериев сходства или различия строения кристаллов. Обычно структурный тип относят к названию одного из веществ, кристаллизующихся в нём. Структуры кристаллов, принадлежащих к одному структурному типу, одинаковы до подобия. Структурный тип в кристаллографии определяет относительное расположение частиц (атомов или атомных групп) в кристалле, без указаний абсолютных расстояний между ними. Чтобы описать конкретную структуру, надо указать структурный тип и параметры структуры.
К важнейшим и распространенным структурным типам относятся: структура меди (тип А
), структура вольфрама (тип А 2
), структура магния (тип А 3
), структура алмаза (тип А 4
), структура графита (тип А 9
), структура каменной соли (тип В 1
), структура перовскита (тип Е 2
), структура шпинели (тип Н 11
).
Тип А
(Структура меди)
В структурном типе меди кристаллизуются очень многие металлы: золото, серебро, никель, алюминий, кальций, торий, свинец и др. Все эти металлы сравнительно мягкие, пластичные, легко обрабатываются. Многие из них образуют непрерывные ряды твердых растворов, например, Ag-Au, Cu-Au. Структурой типа меди обладают также интерметаллические соединения AuSb, Au 2 Bi, Au 2 Pb, Cu 2 Mg, Bi 2 K, ZrH, TiH и др.
Элементарная ячейка меди - кубическая, гранецентрированная. Атомы располагаются в вершинах и центрах граней F -ячейки. На элементарную ячейку приходится 4 атома. Каждый атом окружен 12 ближайшими атомами, координационное число (к.ч.) =12. Координационный многогранник - кубооктаэдр. В структуре имеется одна правильная система точек с кратностью 4. Плотнейшие слои 1 перпендикулярны направлениям. Плотнейшая упаковка кубическая трехслойная....АВСАВС....Пространственная группа Fm3m.
Тип А 2
(Структура вольфрама)
К структурному типу вольфрама (тип ОЦК-металлов) относятся тугоплавкие металлы: хром, ванадий, молибден, ниобий, тантал, -кобальт, -железо, титан, цирконий, гафний, щелочные элементы - литий, натрий, калий, рубидий, цезий, щелочноземельные - кальций, стронций, барий, актиниды - уран, нептуний, плутоний. Из интерметаллических соединений в ОЦК-структуре кристаллизуются AgZn, Cu 3 Al, CoAl, Cu 5 Sn, LiAg, LiAl, TaH и др.
В объемно-центрированной кубической ячейке вольфрама атомы располагаются по вершинам и в центре ячейки, т.е. на одну ячейку приходится два атома. ОЦК-структура не является плотнейшей упаковкой атомов. Коэффициент компактности равен 0,68. Пространственная группа вольфрама Im3m.
Тип А3
(Структура магния)
В структурном типе магния кристаллизуются гексагональные металлы: кадмий, бериллий, таллий, титан, никель, хром и др. Эта структура также характерна для интерметаллических соединений AgCd, AgCd 3 , AuCd, AuCd 3 , CuCd 3 , AgZn 3 , AuZn 3 , NiMo, TiH, W 2 С и др.
Элементарная ячейка магния - элементарная примитивная. Центры атомов располагаются по вершинам правильных шестиугольников: в трех вершинах - через одну, - атомы верхнего слоя, в трех других вершинах - атомы нижнего слоя. Элементарная ячейка построена на трех трансляциях, две из которых лежат в плотно упакованном слое атомов и составляют между собой угол = 120 о, третья перпендикулярна этому слою. Элементарную ячейку можно разделить плоскостью на две тригональные призмы. В центре одной из призм расположен атом, другая свободна, заселенные и пустые призмы чередуются между собой. На элементарную ячейку приходится два атома магния.
Каждый атом магния окружен двенадцатью ближайшими атомами: шестью - в том же слое, тремя в соседнем слое сверху и тремя в соседнем слое снизу, к.ч.=12. Плотные слои - плоскости базиса (0001), упаковка гексагональная, двухслойная....АВАВАВАВ.... Кристаллы металлов с плотно упакованной гексагональной структурой легче всего деформируются по плоскостям (0001) и направлениям, соответствующим наиболее плотной упаковке атомов. Координационный многогранник - гексагональный кубооктаэдр. Пространственная группа магния Р63/mmc.
Изучение металлов в соответствии с периодической системой элементов Менделеева показывает, что за исключением Mn и Hg элементы подгруппы А, в том числе переходные металлы и большинство редкоземельных элементов, а также металлы подгрупп IB и IIB и некоторые элементы группы IIIB, в том числе Al образуют одну из следующих типичных металлических структур:
А 1 - кубическая гранецентрированная решетка (ГЦК)
Кубической гранецентрированной решеткой обладают следующие металлы: g - Fe, Al, Cu, Ni, a - Co, Pb, Ag, Au, Pt и др.
В кубической гранецентрированной решетке атомы располагаются по вершинам элементарной ячейки и в центрах ее граней (рис.1.5).
Каждый атом в этой решетке окружен 12-ю ближайшими соседями, располагающихся на одинаковых расстояниях, равных = 0,707×а , где а - ребро элементарной ячейки. Число ближайших соседей, равное 12-ти называется координационным числом кристаллической решетки. Кроме этих ближайших атомов, в кристаллической решетке имеется 6 атомов, удаленных на значительно большие расстояния, равные а .
Рассматриваемая кристаллическая решетка имеет два вида пустот, (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах) образующих твердые растворы внедрения.
Наибольшие междоузлия или пустоты находятся в центре куба и посередине его ребер. Каждая из этих пустот окружена шестью атомами ГЦК решетки, занимающими места в вершинах правильного октаэдра. В связи с этим, они называются октаэдрическими пустотами (рисунок 1.5, б ). Такие положения различных элементов в гранецентрированной кубической решетке занимают атомы Na и Cl в решетке NaCl. Такие же положения занимает углерод в решетке g - Fe.
Кроме этих пустот в ГЦК решетке имеются более мелкие пустоты, называемые тетраэдрическими, в связи с тем, что их окружают 4 атома. Всего в ГЦК решетке 8 тетраэдрических пустот (рисунок 1.5, в ).
Размеры тетраэдрических и октаэдрических пустот можно ощутить, если предположить, что решетка построена из жестких шаров, радиусом r, соприкасающихся друг с другом; в этом случае в имеющиеся промежутки можно было бы поместить сферы, радиусом 0,41 r и 0,225 r соответственно для октаэдрической и тетраэдрической пустот.
Наиболее плотноупакованными плоскостями в структуре гранецентрированного куба являются плоскости изображенные на рисунке. Их условное обозначение {111} (рисунок 1.5., г ).
Объемно-центрированную кубическую решетку А 2 (ОЦК) имеют металлы a - Fe, хром, вольфрам, молибден, ванадий, натрий, литий и другие. Структура А 2 является менее плотноупакованной.
Атомы в решетке ОЦК располагаются в вершинах и в центре элементарной ячейки (рисунок 1.6).
Каждый атом в этой ячейке имеет 8 ближайших соседей, располагающихся на расстоянии где, а - длина ребра куба. Следовательно, координационное число решетки равно 8. Иногда его обозначают (8 + 6), т.к. следующие по удаленности атомы расположено на расстоянии а, число их равно 6.
В структуре ОЦК также имеются 2 типа пустот. Крупные занимают положения на гранях куба (рисунок 1.6, в ). Они окружены 4 атомами, располагающимися в вершинах тетраэдра, ребра которых попарно равны. Более мелкие пустоты, окруженные 6 атомами, занимающими места в вершинах неправильного октаэдра, располагаются посередине ребер и граней ячейки (рисунок 1.6, г ). Если структуру ОЦК решетки построить из жестких шаров, то в тетраэдрические пустоты можно поместить сферы радиусом 0,292 r, а в октаэдрические - 0,154 r.
Таким образом, максимальный размер сферы, которую можно поместить в пустоты более плотно упакованной решетки ГЦК оказывается большим, чем в решетку ОЦК.
Внедрение других атомов в октаэдрическую пору ОЦК решетки вызывает смещение двух атомов в направлении параллельными ребру куба, что вызывает расширение решетки в этом направлении. В структуре мартенсита, где атомы углерода внедряются в октаэдрические пустоты, расположенные только на ребрах, параллельных оси С и в центрах граней, перпендикулярных этой оси, это приводит к тетрагональному искажению решетки a - Fe.
Наиболее плотноупакованными плоскостями ОЦК являются 12 плоскостей семейства {110} (рисунок 1.6.б ). В этих плоскостях имеются 2 направления, в которых жесткие шары могут соприкасаться.
Гексагональной плотноупакованной решеткой А 3 (ГПУ) обладают такие металлы, как Zn, b - Co, Cd, Mg, a - Ti, a - Zr.
Гексагональная решета построена из отдельных слоев, причем таким образом, что каждый атом любого слоя окружен 6 расположенными на равных расстояиях соседями, принадлежащими этому же слою, и, кроме того, имеет по три ближайших соседа в слоях, расположенных выше и ниже данного слоя (рисунок 1.7).
Расстояние между атомами в гексагональных слоях обозначается через а , высота ячейки через с. Шесть ближайших соседей, расположенных в смежных слоях будут также находиться на расстоянии, а от данного атома, если отношение осей с/а составит, то такая структура называется идеальной плотноупакованной. Причем координационное число в этом случае, также как и в ГЦК решетке, равно 12.
Большинство металлов с гексагональной плотноупакованной решеткой имеет отношение осей с/а = 1,56 - 1,63. Исключения составляют Zn и Cd (1,86; 1,89). Это связано с тем, что электронные облака атомов Zn и Cd не обладают сферической симметрией и вытянуты вдоль оси С. В гексагональной плотноупакованной решетке, также как и в ГЦК, имеется 2 вида пустот: октаэдрические и тетраэдрические (рисунок 1.7, б ).
Диаметры жестких сфер, которые могут быть помещены в эти пустоты также как и для ГЦК равны 0,41 r и 0,225 r.
Достаточно взглянуть на построение плотноупакованных плоскостей ГЦК решетки {111} (рисунок 1.8, а ), чтобы найти полную аналогию в построении атомов в этих двух решетках. Разница этих решеток состоит в чередовании слоев. Если в гексагональной решетке происходит чередование слоев АВАВ и т.д., то в ГЦК решетке: АВСАВС (рисунок 1.8, б ), т.е. при этом используется третье возможное положение плотноупакованного слоя.
Разница в энергетическом отношении между этими двумя решетками незначительна и, в связи с этим, последовательность чередования слоев может легко нарушиться при пластической деформации, а также в результате возникновения дефектов кристалла во время его роста, так называемых дефектов упаковки.
Таким образом, кажущаяся разница в построении ГПУ и ГЦК решетки совсем не велика (рисунок 1.8).
Углерод в виде алмаза, кремний, германий, a - олово (серое) имеют двойную кубическую решетку типа алмаза (рисунок 1.9). Она отличается от ГЦК решетки наличием в четырех из восьми тетраэдрических пустот дополнительно четырех атомов. В результате, структура оказывается более рыхлой.
Каждый атом алмаза окружен лишь четырьмя ближайшими соседями, располагающимися в углах правильного тетраэдра. Координационное число такой структуры равно 4.
Как было показано выше, одни и те же металлы при разных температурах могут иметь разное кристаллическое строение, что вызвано их аллотропией.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела.
В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы a - Fe с объемно-центрированной кубической решеткой в высокотемпературную форму g - Fe с гранецентрированной кубической решеткой, при температуре 910 °С и последующее превращение при температуре 1392 °С g - Fe в d - Fe с объемно-центрированной кубической решеткой, аналогичной a - Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются a - Ti, a - Zr с гексагональной плотноупакованной решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются b - Ti и b - Zr, обладающие объемно-центрированной решеткой.
Как вы видели, аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава претерпевающего аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла. Температура перехода называется критической точкой превращения. При температуре (Т 0) наблюдается фазовое равновесие двух аллотропических разновидностей.
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева при нагреве.
Аллотропическое превращение происходит, так же как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии.