Planul schiță a lecției
Articol: Chimie
Clasă: 8
Manual: Chimie: Chimie anorganică. clasa a 8-a. Rudzitis G. E., Feldman F. G.
Tema lecției: „Producerea oxigenului și studiul proprietăților acestuia”
Ţintă – consolidarea și îmbunătățirea cunoștințelor elevilor despre principalele metode de producere a oxigenului în condiții de laborator și studierea proprietăților acestuia.
Sarcini:
Educational :
studiul metodelor de producere a oxigenului (prin deplasarea aerului și prin deplasarea apei), proprietățile sale fizice și chimice;
Educarea :
dezvoltarea orizontului elevilor;
independență, acuratețe, muncă grea, cooperare, observație,cultiva o atitudine grijuliepentru lumea plantelor, deoarece plantele sunt producători de oxigen;
De dezvoltare :
capacitatea de a compune ecuații ale reacțiilor chimice;
respectarea reglementărilor de siguranță în timpul experimentelor chimice;
capacitatea de a trage concluzii.
Tip de lecție: Lecție privind îmbunătățirea și aplicarea cunoștințelor (lucru practică).
Echipamente și reactivi necesari: un stand de laborator cu eprubete, un dop cu tub de evacuare a gazului, un balon cu fund plat, linguri pentru arderea substanțelor (cu dop), un arzător și chibrituri, așchii, un cristalizator cu apă, o placă de sticlă; permanganat de potasiuKMnO 4, cărbune C (pulbere), apă de varCa( OH) 2 .
Etapele principale ale lecției:
1.
2. Partea introductivă (10 min)
3. Partea principală (20 min)
4. Partea finală (13 min).
Etapele principale ale lecției, timpul
Metode
Conținutul materialului educațional, activitățile profesorului
Conținutul materialului educațional, activitățile studenților
Notă
Parte organizatorică (2 min)
Salutari studenti. Îi marchez pe cei absenți. Îmi verific pregătirea pentru lecție.
Salutări profesor. Șeful numește pe cei absenți.
Partea introductivă (10 min)
Conversaţie
Scopul lecției de astăzi este de a obține oxigen în condiții de laborator prin deplasarea aerului și, de asemenea, de a studia proprietățile fizice și chimice ale acestuia.
Înainte de a începe lucrările practice, profesorul trebuie să-i familiarizeze pe elevi cu regulile de siguranță (vezi Anexa 1).
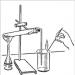
Profesorul arată apoi cum să asamblați și să utilizați corect dispozitivul de producere a oxigenului.

Un dispozitiv pentru colectarea oxigenului prin metoda deplasării aerului.
În timpul asamblarii dispozitivului, profesorul adresează elevilor următoarele întrebări:
1. De ce cana de colectare a oxigenului este situată cu susul în jos și nu cu susul în jos? Explica?
2. Enumerați proprietățile fizice ale oxigenului? Oxigenul poate fi lichid sau solid?
3. Cum se dovedește că există oxigen în sticlă?
Elevii ascultă cu atenție regulile de siguranță. Ei pun întrebări despre muncă. Notează regulile într-un caiet.
Elevii schițează dispozitivul și trebuie să indice în desen: un trepied, o eprubetă cu permanganat de potasiu, un arzător, un pahar.
Răspunsuri la întrebări:
1. Oxigenul este mai greu decât aerul. Când n. u. 1 litru de oxigen cântărește 1,43 g, iar aerul 1,29 g.
2. Oxigenul este un gaz incolor, inodor și fără gust, ușor solubil în apă, mai greu decât aerul. La o presiune de 760 mm. rt. Artă. și temperatura – 183° Oxigenul se lichefiază, iar când temperatura scade la – 218,8° C se intareste.
3. Puteți dovedi prezența oxigenului într-un pahar folosind o așchie.
Partea principală (20 min)
Experimentul elevilor
După ce profesorul a explicat regulile de asamblare a dispozitivului, el împarte elevii în grupuri și distribuie cartonașe - instrucțiuni (vezi Anexa 2).
În timpul lucrărilor practice, profesorul observă executarea corectă a tehnicilor și operațiilor de către elevi.
Elevii citesc carduri - instrucțiuni pentru lucrări practice, pun întrebări dacă progresul lucrărilor practice nu este clar.
După ce s-au familiarizat cu harta - instrucțiuni, elevii încep să efectueze lucrări practice.
După efectuarea experimentelor, elevii completează un raport final și trag o concluzie generală.
Profesorul poate afișa raportul pe un diapozitiv separat sau îl poate include într-o fișă de instrucțiuni.
Partea finală (13 min)
Muncă independentă
La sfârșitul lecției, profesorul distribuie elevilor fișe demonstrative cu lucru independent (vezi Anexa 3).
Efectuați muncă independentă în caiete pentru muncă independentă/de test. Predați caietele profesorului.
În sarcina 4, elevii sunt împărțiți în 3 opțiuni, fiecare opțiune având o sarcină corespunzătoare.
Anexă la notele lecției
Anexa 1. Reglementări de siguranță.
Manipulați echipamentele chimice cu grijă!
Tine minte! Eprubeta este încălzită ținând-o într-o poziție înclinată pe toată lungimea sa cu două sau trei mișcări în flacăra unei lămpi cu alcool. Când încălziți, îndreptați deschiderea eprubetei departe de dvs. și de vecini.

Stingeți lampa cu alcool numai cu capacul (a).
Este interzisă aprinderea unei lămpi cu alcool cu alta (b).
Este interzisă trecerea lampa cu alcool în timp ce aceasta este aprinsă (c).
Este interzisă gustarea substanței (g).
Lucrați numai deasupra mesei (e).
Anexa 2. Hartă - instrucțiuni pentru lucrări practice „Obținerea oxigenului și studierea proprietăților acestuia”
Ţintă - învață cum să folosești echipamentele de laborator și sticlăria pentru a obține, colecta și dovedi prezența oxigenului și respectă regulile de siguranță.
În această lucrare veți studia una dintre metodele de laborator pentru producerea oxigenului și proprietățile acestuia. Aflați rolul catalizatorului. Îmbunătățiți-vă capacitatea de a opera instrumente. Învață să colectezi oxigenul în diverse moduri, să dezvolți abilități în încălzire și utilizarea dispozitivelor de încălzire, respectând regulile de siguranță atunci când lucrezi cu dispozitive de încălzire, când încălziți, când asamblați dispozitive.
Echipamente
Reactivi
Raft de laborator cu eprubete
Dop cu conducta de evacuare a gazului
Balon cu fund plat
Linguri pentru arderea substanțelor (cu dop)
Arzător și chibrituri, așchii
Cristalizator cu apă
Farfurie de sticla
Permanganat de potasiuKMnO 4
peroxid de hidrogen (20%)H 2 O 2
Oxid de mangan (IV) MnO 2
Cărbune (pulbere)
sulf (pulbere)
Roșu fosfor
Sârmă de fier (sau ac)
Sarcina 1. Verificarea dispozitivului pentru scurgeri.

Sarcina 2. Obținerea oxigenului prin încălzirea permanganatului de potasiu
1. Deplasarea aerului
Încălziți eprubeta cu flacăra unei lămpi cu alcool (deplasând uniform flacăra lămpii cu alcool de-a lungul eprubetei); Așezați lampa cu alcool sub partea în care se află permanganatul de potasiu.
Colectați oxigenul prin deplasarea aerului din sticlă.
Verificați dacă paharul este umplut cu oxigen: aduceți o așchie care mocnește în gaura din sticlă.
2. Colectarea oxigenului „de deasupra apei”

 Scoateți tubul de evacuare a gazului din paharul cu apă fără a opri încălzirea eprubetei cu permanganat de potasiu, altfel apa din sticlă se poate transfera în eprubeta fierbinte!
Scoateți tubul de evacuare a gazului din paharul cu apă fără a opri încălzirea eprubetei cu permanganat de potasiu, altfel apa din sticlă se poate transfera în eprubeta fierbinte!
3. Arderea cărbunelui în oxigen. Dovada prezenței
CO
2


Trimiteți un raport de lucru:
Operațiuni efectuate
(ce făceau ei)
Observatii. Condiții
efectuarea reacțiilor.
Ecuații de reacție
Explicațiile observațiilor. concluzii
Asamblarea unui dispozitiv pentru producerea oxigenului. Verificarea dispozitivului pentru scurgeri
Obținerea oxigenului
din KMnО 4
când este încălzită
Dovada obținerii oxigenului folosind
aşchiu mocnit
Caracteristicile proprietăților fizice ale O 2
. Colectarea Despre 2
doua metode:
prin deplasarea aerului,
prin deplasarea apei
Caracteristică
proprietăți chimice DESPRE 2
. Interacţiune
cu substante simple:
carbune aprins.
CONCLUZIE: _________________________________________________________
Exemplu de raport privind munca practică efectuată
Operațiuni efectuate
(ce făceau ei)
Desene cu denumiri ale substanțelor inițiale și obținute
Observatii.
Condiții
efectuarea reacțiilor. Ecuații de reacție
Explicațiile observațiilor.
concluzii
Asamblarea unui dispozitiv pentru producerea oxigenului.
Verificarea dispozitivului pentru scurgeri

Se eliberează bule de aer
Aparatul este asamblat ermetic
Obținerea oxigenului din KMnO 4
când este încălzită

Când este încălzit KMnO 4 are loc reactia:

DESPRE 2 obţinute în laborator prin descompunerea KMnO 4 când este încălzită
Dovada producerii de oxigen folosind
aşchiu mocnit
Aşchie mocnind
(cărbunele) se aprinde puternic
eu nu 2
Gazul rezultat O 2 susține arderea
Caracteristică
proprietățile fizice ale O 2
. Colectarea Despre 2
doua metode:
deplasarea aerului (aerului),
prin deplasarea apei (b)

Oxigenul înlocuiește aerul și apa din vase
Oxigenul este un gaz incolor și inodor.
puțin mai greu decât aerul, deci
se colectează într-un vas aşezat la fund. Oxigenul este ușor solubil în apă
Caracteristicile proprietăților chimice ale O 2 . Interacțiunea cu substanțe simple: arderea cărbunelui.

Un cărbune încins arde puternic în O 2 :

Apa de var devine tulbure deoarece se formează un precipitat de CaCO insolubil în apă 3
:
CO 2
+ Ca(OH) 2
CaCO 3
+H 2
O.
DESPRE 2
interactioneaza
cu simplu
substanțe – metale și nemetale. Formarea unui precipitat alb confirmă prezența CO în balon 2
CONCLUZIE: Una dintre modalitățile de obținere a oxigenului în laborator este descompunerea KMnO 4 . Oxigenul este un gaz incolor și inodor, de 1.103 ori mai greu decât aerul (M r (O 2 ) = 32, M r (aer) = 29, ceea ce înseamnă 32/291,103), ușor solubil în apă. Reacționează cu substanțele simple, formând oxizi.
Anexa 3. Card pentru munca independentă (card Demo).
1) Completați spațiile libere din tabel:
Numele experienței
Ecuația reacției, condițiile de curgere
Observare
1. Chitanță O 2 din KMnO 4
…KMnO 4 K 2 MnO 4 +MnO 2 +O 2
Când este încălzitKMnO4iese în evidență ___________ .
2. Recunoașterea oxigenului
____________
Când adăugați ________ așchii într-un pahar (balon) cuO 2 ea ________________.
3. Proprietăți fizice O 2
_____________
La temperatura camereiO 2 este în stare ____________.O 2 __________________aer.
(mai ușor/mai greu )
4. Cărbune care arde O 2
CU + O 2 …
Cărbunele arde înăuntruO 2 Mai mult ___________ decât în aer.
5. Studiul produsului de ardere în O 2
… + Ca(OH) 2 … + H 2 O
Apă de var_________ decât ca atunci când ardeți cărbuneO 2 ____ este format.
2) Care dintre proprietățile fizice pot fi atribuite oxigenului (n.o.): mai ușor decât aerul,mai greu decât aerul , solid, lichid,gaz , incolor , verde, albastru, solubil în apă,usor solubil in apa , conductor electric, miros înțepător, dulce, acru.
3) Completați schemele de reacție care stau la baza metodelor de laborator pentru producerea oxigenului. Configurați cotele:
A)H 2 O+
G)HgO Hg +
4) Sarcina 1: Determinați care compus de fier este Fe 2 DESPRE 3 sau Fe 3 DESPRE 4 – mai bogat în fier?
Problema 2: Ce număr de molecule sunt conținute în 2,5 moli de oxigen?
Problema 3: Determinați cantitatea de substanță și numărul de molecule care alcătuiesc 12 g de oxigen?
Bibliografie:
1. Fișe - instrucțiuni pentru orele practice la chimie clasele 8 -11. T. S. Nazarova, V. N. Lavrova.
2. Caiet de lucru la chimie clasa a VIII-a. Guzey L.S.
3. Erygin D.P., Shishkin E.A. Metode de rezolvare a problemelor de chimie: Manual. manual pentru elevii pedagogici. Institutul de Biol. si chimic. specialist. – M.: Educație, 1989.
4. KataevaL.G., Tolkacheva T.K.Carduri- sarciniDeanorganicchimie: 8 Clasă- 96 s.
5. Probleme de chimie și modalități de rezolvare a acestora, clasele 8-9. Gabrielyan O. S.
Lucrarea practică nr. 3
Producția și proprietățile oxigenului.
Scopul lucrării:învață să folosești echipamentele de laborator și sticlăria pentru obținerea, colectarea și demonstrarea prezenței oxigenului, studiul metodelor de obținere și colectare a oxigenului în laborator, precum și proprietățile chimice ale oxigenului.
Echipamente și reactivi: suport de laborator, picior, lampă cu alcool, chibrituri, eprubetă, dop cu tub de evacuare gaz, așchiu, lingură pentru arderea substanțelor, cilindru, pahar, cristalizator cu apă, vată, permanganat de potasiu (solid) KMnO 4, cărbune, sulf, apă de var Ca (OH) 2
Norme de siguranță.
Manipulați echipamentele chimice cu grijă!
Tine minte! Eprubeta este încălzită ținând-o într-o poziție înclinată pe toată lungimea sa cu două sau trei mișcări în flacăra unei lămpi cu alcool. Când încălziți, îndreptați deschiderea eprubetei departe de dvs. și de vecini.
Progres:
Experimentul 1. Obținerea și colectarea oxigenului
a) Colectarea oxigenului prin metoda deplasării aerului
- Asamblați dispozitivul așa cum se arată în figură:
1 - vată de sticlă, 2 - aer
Pentru a face acest lucru, fixați eprubeta cu permanganat de potasiu KMnO 4 în piciorul trepiedului, închideți-o cu un dop cu un tub de evacuare a gazului, al cărui capăt este coborât într-un pahar gol.
- Verificați dacă paharul este complet umplut cu oxigen folosind o așchie care mocnește.
- În caiet pentru lucrări practice, faceți un desen al dispozitivului. Notați observațiile și ecuația pentru reacția de producere a oxigenului.
b) Colectarea oxigenului prin metoda deplasării apei
- Asamblați dispozitivul pentru producerea de oxigen așa cum se arată în figură:
1 - vată de sticlă, 2 - apă
Pentru a face acest lucru, fixați eprubeta cu permanganat de potasiu KMnO 4 în gheară, închideți-o cu un dop cu un tub de evacuare a gazului, al cărui capăt este coborât într-un cilindru de măsurare inversat plasat într-un cristalizator cu apă.
- Încălziți întreaga eprubetă cu flacăra unei lămpi cu alcool, apoi continuați încălzirea fundului eprubetei timp de 5-6 minute.
- În caiet pentru lucrări practice, faceți un desen al dispozitivului. Înregistrați-vă observațiile. Concluzionați în ce moduri poate fi colectat oxigenul în laborator.
Experimentul 2. Studiul proprietăților oxigenului
a) Arderea carbonului în oxigen
Puneți o bucată de cărbune într-o lingură pentru arderea substanțelor și încălziți-o în flacăra unei lămpi cu alcool. Apoi puneți o lingură de cărbune mocnit într-un vas cu oxigen și urmăriți ce se întâmplă. Notează-ți observațiile în caiet. Când arderea se oprește, turnați puțină apă de var în vas și agitați. Înregistrați-vă observațiile în caiet. Scrieți ecuația pentru reacția de ardere a cărbunelui.
b) Arderea sulfului în oxigen (Experimentul se desfășoară într-o hotă!)
Pune o bucată de sulf într-o lingură de fier și dă-o foc în flacăra unei lămpi cu alcool. Observați cum arde sulful în aer. Apoi puneți sulful care arde într-un vas cu oxigen. Notați observațiile și ecuația pentru reacția de ardere a sulfului.
Scrie un raport despre munca efectuată folosind tabelul.
Fă-o comună concluzie la locul de muncă, pe baza scopului muncii.
Faceți ordine locul tau de munca.


1) Au o structură nemoleculară:
Au o structură moleculară:
2) Substanțele cu structură nemoleculară sunt situate într-un solid starea de agregareși au puncte de topire ridicate. Substanțele cu structură moleculară pot fi solide, lichide sau gazoase și au puncte de topire scăzute.
3) Acești oxizi pot fi obținuți, de exemplu, prin arderea unor substanțe simple.
Lucrări practice 3
Producția și proprietățile oxigenului
1. Primirea și colectarea oxigenului. A) Acțiuni: Se încălzește eprubeta cu permanganat de potasiu pe o lampă cu alcool. Puneți o așchie care mocnește într-un pahar cu oxigen. Observatii: Când sunt încălzite, particulele de permanganat de potasiu sar și trosnesc. O așchie mocnitoare se aprinde... Concluzie: Oxigenul poate fi obținut din descompunerea permanganatului de potasiu. Oxigenul => este un gaz incolor. Oxigenul este mai greu decât aerul. Oxigenul nu are miros. Oxigenul susține arderea și este insolubil în apă.
b) Acțiuni: Asamblam un dispozitiv pentru producerea oxigenului și colectarea acestuia prin deplasarea apei. Se încălzește permanganatul de potasiu.
Observatii: Apa din eprubetă este forțată în cristalizator.
Concluzie: Oxigenul este insolubil în apă.
2. Arderea cărbunelui și a sulfului în oxigen. A) Acțiuni:Încinge o bucată de cărbune și pune-o într-un pahar cu oxigen. După ce arderea se oprește, turnați apă de var în pahar.
Scopul lucrării
Echipamente și reactivi necesari
Echipament:
- suport de laborator cu picior sau suport pentru eprubete;
- lampă cu alcool;
- două pahare;
- farfurie de sticla;
- eprubetă;
- dop cu tub de evacuare a gazului;
- lingura pentru arderea substantelor;
- chibrituri;
- așchie;
- lână de bumbac
Substante:
- permanganat de potasiu (solid) KMnO4;
- cărbune C;
- apă de var - Ca(OH) 2.
Masuri de precautie
Lucrul cu o lampă cu alcool:
- Nu purtați o lampă cu alcool arzând dintr-un loc în altul.
- Stingeți lampa cu alcool numai cu capacul.
- Când încălziți, nu uitați să încălziți eprubeta. Pentru a face acest lucru, treceți încet eprubeta, fixată în piciorul trepiedului, prin flacără de jos până în gaură și înapoi. Repetați această operațiune de mai multe ori pentru ca paharul să se încălzească uniform. Un semn de încălzire a sticlei poate fi considerat dispariția aburirii de pe pereții eprubetei.
- Partea inferioară a eprubetei trebuie să fie în partea de sus a flăcării.
- Partea inferioară a eprubetei nu trebuie să atingă fitilul.
Verificarea dispozitivului pentru scurgeri:
- Închideți eprubeta cu un dop cu un tub de evacuare a gazului, coborâți capătul tubului într-un paharcu apă. Puneți strâns palma în jurul eprubetei și urmăriți cu atenție să apară bule de aer.
FINALIZAREA LUCRĂRII
Descărcați pe rând următoarele două experimente video și urmăriți cu atenție experimentul:
1.
Obținerea oxigenului(faceți clic pe „Vedeți experiența”)
Oxigenul (O 2) se obţine în laborator prin descompunerea permanganatului de potasiu KMnO 4 (permanganat de potasiu). Pentru experiment veți avea nevoie de o eprubetă cu tub de evacuare a gazului. Se toarnă permanganat de potasiu cristalin într-o eprubetă. Să pregătim un balon pentru a colecta oxigen. Când este încălzit, permanganatul de potasiu începe să se descompună, oxigenul eliberat curge prin tubul de evacuare a gazului în balon. Oxigenul este mai greu decât aerul, așa că nu părăsește balonul și îl umple treptat. O așchie care mocnește în balon: înseamnă că am reușit să colectăm oxigen.
2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
Oxigenul pur a fost obținut pentru prima dată independent de chimistul suedez Scheele (prin calcinarea salitrului) și omul de știință englez Priestley (prin descompunerea oxizilor de mercur și plumb). Înainte de descoperirea lor, oamenii de știință credeau că aerul este o substanță omogenă. După descoperirea lui Scheele și Priestley, Lavoisier a creat teoria arderii și a numit noul element Oxigeniu (lat.) - generator de acid, oxigen. Oxigenul este necesar pentru a menține viața. O persoană poate supraviețui fără oxigen doar câteva minute.
2. Detectarea oxigenului
Oxigenul sprijină arderea - această proprietate a oxigenului este folosită pentru a-l detecta
3. Arderea cărbunelui în oxigen
Oxigenul interacționează activ cu multe substanțe. Să vedem cum reacționează oxigenul cu cărbunele. Pentru a face acest lucru, încălziți o bucată de cărbune pe flacăra unei lămpi cu alcool. În aer, cărbunele abia mocnește, deoarece oxigenul din atmosferă este de aproximativ douăzeci la sută din volum. Într-un balon cu oxigen, cărbunele este încălzit. Arderea carbonului devine intensă. Când carbonul este ars, se formează dioxid de carbon:
C+O2 = CO2
Adăugați apă de var în balonul cu gaz - devine tulbure. Apa de var detectează dioxidul de carbon. Amintește-ți cum se reaprinde un foc pe moarte. Ele suflă pe cărbuni sau îi ventilați intens pentru a crește aportul de oxigen în zona de ardere.
Pregătiți și transmiteți un raport cu privire la munca depusă
Lucrarea practică nr. 3
Producția și proprietățile oxigenului
Scopul lucrării :
Obține oxigen (prin metoda deplasării aerului) și studiază proprietățile acestuia.
Instrumente și echipamente : KMnO 4 – permanganat de potasiu (permanganat de potasiu), C – cărbune, apă de var, dop cu tub de evacuare a gazului, așchie, lampă cu alcool, chibrituri, balon, vată, eprubetă.
Progres :
|
Numele experimentului, desen |
Observatii, concluzii Ecuația reacției chimice |
|
1. Primirea și colectarea oxigenului
|
KMnO 4 t = K 2 MnO 4 +.?.+.?.(numiți produsele) |
LUCRĂRI PRACTICE (1 oră) CLASA A VIII-A
Lucrarea este efectuată de elevi în mod independent, sub supravegherea profesorului.
Vă prezint rezultatul multor ani de muncă în pregătirea și desfășurarea lucrărilor practice într-o școală secundară în timpul lecțiilor de chimie din clasele 8-9:
- „Pregătirea și proprietățile oxigenului”,
- „Prepararea soluțiilor de sare cu o anumită fracțiune de masă de substanță dizolvată”,
- „Generalizarea informațiilor despre cele mai importante clase de compuși anorganici”,
- „Disocierea electrolitică”
- „Subgrupul de oxigen” (vezi numărul următor al ziarului „Chimie”).
Toate au fost testate de mine în clasă. Ele pot fi folosite atunci când studiază un curs școlar de chimie atât conform noului program al lui O.S. Gabrielyan, cât și conform programului lui G.E. Rudzitis, F.G. Feldman.
Un experiment de elev este un tip de muncă independentă. Experimentul nu numai că îmbogățește elevii cu noi concepte, abilități și abilități, dar este și o modalitate de a testa adevărul cunoștințelor pe care le-au dobândit, contribuie la o înțelegere mai profundă a materialului și la asimilarea cunoștințelor. Vă permite să implementați mai pe deplin principiul variabilității în percepția lumii înconjurătoare, deoarece esența principală a acestui principiu este legătura cu viața, cu viitoarele activități practice ale studenților.
Goluri. Să poată obține oxigen în laborator și să-l colecteze folosind două metode: deplasarea aerului și deplasarea apei; confirma experimental proprietățile oxigenului; cunoaște regulile de siguranță.
Echipamente. Un suport metalic cu un picior, o lampă cu alcool, chibrituri, o eprubetă cu tub de evacuare a gazului, o eprubetă, o bilă de vată, o pipetă, un pahar, o așchie, un ac de disecție (sau sârmă), o cristalizator cu apa, doua baloane conice cu dopuri.
Reactivi. KMnO 4 cristalin (5–6 g), apă de var Ca(OH) 2, cărbune,
Fe (sârmă de oțel sau agrafă).
Norme de siguranță.
Manipulați echipamentele chimice cu grijă!
Tine minte! Eprubeta este încălzită ținând-o într-o poziție înclinată pe toată lungimea sa cu două sau trei mișcări în flacăra unei lămpi cu alcool. Când încălziți, îndreptați deschiderea eprubetei departe de dvs. și de vecini.
Anterior, elevii primesc teme pentru acasă, asociat cu studierea conținutului lucrării viitoare conform instrucțiunilor, folosind simultan materiale din manualele de clasa a VIII-a de O.S. Gabrielyan (§ 14, 40) sau G.E. Rudzitis, F. G. Feldman (§ 19, 20). În caietele pentru lucrări practice, notați numele temei, scopul, enumerați echipamentele și reactivii și întocmește un tabel pentru raport.
ÎN CURILE CURĂRILOR
Am pus o experiență mai sus
decat o mie de pareri
născut numai
imaginație.
M.V. Lomonosov
Obținerea oxigenului
metoda deplasării aerului
(10 minute)
1. Puneți permanganatul de potasiu (KMnO4) într-o eprubetă uscată. Puneți o minge de vată liberă la deschiderea eprubetei.
2. Închideți eprubeta cu un dop cu tub de evacuare a gazului și verificați dacă există scurgeri (Fig. 1).
|
Orez. 1.
|
(Explicații de la profesor despre cum să verificați dispozitivul pentru scurgeri.) Fixați dispozitivul în piciorul trepiedului.
3. Coborâți tubul de evacuare a gazului în sticlă, fără a atinge fundul, la o distanță de 2–3 mm (Fig. 2).
4. Se încălzește substanța în eprubetă. (Amintiți-vă regulile de siguranță.)
5. Verificați prezența gazului cu o așchie care mocnește (cărbune). Ce observi? De ce poate fi colectat oxigenul prin deplasarea aerului?
6. Se colectează oxigenul rezultat în două baloane pentru următoarele experimente. Sigilați baloanele cu dopuri.
7. Completați raportul folosind tabelul. 1, pe care îl plasați pe întinderea caietului dvs.
Obținerea oxigenului
metoda de deplasare a apei
(10 minute)
1. Umpleți eprubeta cu apă. Închideți eprubeta cu degetul mare și întoarceți-o cu susul în jos. În această poziție, coborâți mâna cu eprubeta în cristalizatorul cu apă. Puneți o eprubetă la capătul tubului de evacuare a gazului fără a o scoate din apă (Fig. 3).
2. Când oxigenul înlocuiește apa din eprubetă, închideți-o cu degetul mare și scoateți-o din apă. De ce poate fi colectat oxigenul prin deplasarea apei?
Atenţie! Scoateți tubul de evacuare a gazului din cristalizator în timp ce continuați să încălziți eprubeta cu KMnO4. Dacă nu se face acest lucru, apa se va transfera în eprubeta fierbinte. De ce?
Arderea cărbunelui în oxigen
(5 minute)
1. Atașați un cărbune la un fir de metal (ac de disecție) și puneți-l în flacăra unei lămpi cu alcool.
2. Puneți un cărbune încins într-un balon cu oxigen. Ce observi? Dați o explicație (Figura 4).
3. După ce scoateți cărbunele nears din balon, turnați în el 5-6 picături de apă de var
Ca(OH)2. Ce observi? Dă o explicație.
4. Întocmește un raport de lucru în tabel. 1.
Sârmă de oțel (fier) care arde
în oxigen
(5 minute)
1. Atașați o bucată de chibrit la un capăt al sârmei de oțel. Aprinde un chibrit. Puneți un fir cu un chibrit aprins într-un balon cu oxigen. Ce observi? Dați o explicație (Figura 5).
2. Întocmește un raport de lucru în tabel. 1.
tabelul 1
| Operațiuni efectuate (ce făceau ei) |
Desene cu denumiri ale substanțelor inițiale și obținute | Observatii. Condiții efectuarea reacțiilor. Ecuații de reacție |
Explicațiile observațiilor. concluzii |
|---|---|---|---|
| Asamblarea unui dispozitiv pentru producerea oxigenului. Verificarea dispozitivului pentru scurgeri | |||
| Obținerea oxigenului de la KMnO 4 la încălzire |
|||
| Dovada obținerii oxigenului folosind aşchiu mocnit |
|||
| Caracteristicile proprietăților fizice ale O2. Colectarea O2 folosind două metode: prin deplasarea aerului, prin deplasarea apei |
|||
| Caracteristică proprietățile chimice ale O2. Interacţiune cu substante simple: cărbune care arde, fier care arde (sârmă de oțel, agrafă) |
Faceți o concluzie generală scrisă despre munca depusă (5 min).
CONCLUZIE. Una dintre modalitățile de obținere a oxigenului în laborator este descompunerea KMnO 4. Oxigenul este un gaz incolor și inodor, de 1.103 ori mai greu decât aerul ( Domnul(O 2) = 32, Domnul(aer) = 29, ceea ce implică 32/29 1,103), ușor solubil în apă. Reacționează cu substanțele simple, formând oxizi.
Pune-ți ordinea la locul de muncă (3 min): dezasamblați dispozitivul, puneți vasele și accesoriile la locul lor.
Trimiteți caietele pentru verificare.
Teme pentru acasă.
Sarcină. Determinați care dintre compușii de fier - Fe 2 O 3 sau Fe 3 O 4 - este mai bogat în fier?
| Dat: | Găsi: |
| Fe 2 O 3, Fe3O4. |
(Fe) în Fe 2 O 3, „(Fe) în Fe3O4 |
Soluţie
(X) = n A r(X)/ Domnul, Unde n– numărul de atomi ai elementului X din formula substanței.
Domnul(Fe 2 O 3) = 56 2 + 16 3 = 160,
(Fe) = 56 2/160 = 0,7,
(Fe) = 70%,
Domnul(Fe 3 O 4) = 56 3 + 16 4 = 232,
" (Fe) = 56 3/232 = 0,724,
(Fe) = 72,4%.
Răspuns. Fe 3 O 4 este mai bogat în fier decât Fe 2 O 3.
În timpul lucrărilor practice, profesorul observă executarea corectă a tehnicilor și operațiilor de către elevi și le notează pe fișa de abilități (Tabelul 2).
masa 2
Card de îndemânare
| Operatii practice | Numele elevilor | |||||
|---|---|---|---|---|---|---|
| A | B | ÎN | G | D | E | |
| Asamblarea unui dispozitiv pentru producerea oxigenului | ||||||
| Verificarea dispozitivului pentru scurgeri | ||||||
| Întărirea eprubetei în piciorul suportului | ||||||
| Manipularea unei lămpi cu alcool | ||||||
| Încălzirea unei eprubete cu KMnO 4 | ||||||
| Verificarea eliberării O2 | ||||||
| Colectarea O2 într-un vas folosind două metode: prin deplasarea aerului, prin deplasarea apei |
||||||
| Arderea carbunelui | ||||||
| Fe ardere (sârmă de oțel) | ||||||
| Cultura experimentală | ||||||
| Pregătirea lucrării într-un caiet | ||||||
Exemplu de raport privind munca practică efectuată (Tabelul 1)
aşchiu mocnit
(cărbunele) se aprinde puternic
în O 2
proprietățile fizice ale O2. Colectarea O2 folosind două metode:
deplasarea aerului (aerului),
prin deplasarea apei (b)

puțin mai greu decât aerul, deci
se colectează într-un vas aşezat la fund. Oxigenul este ușor solubil în apă


Apa de var devine tulbure deoarece se formează un precipitat de CaCO 3 insolubil în apă:
CO 2 + Ca(OH) 2 CaCO 3 + H 2 O. Fierul arde cu o flacără strălucitoare în oxigen:

cu simplu
substanțe – metale și nemetale. Formarea unui precipitat alb confirmă prezența CO 2 în balon